JL BOSSON(1), D. LUREL(2), JM LUTZ(3), A. BRACHET(2), P. CARPENTIER(2)
(1) Service d’Information et d’Informatique Médicales CHU Grenoble (Pr. Demongeot)
(2) Service de Médecine Interne, Gérontologie Clinique et Angiologie CHU
Grenoble (Pr. Franco)
(3) Registre du Cancer de l’Isère (Dr Ménégoz)
Introduction
Le diagnostic de Maladie Thromboembolique veineuse (MTE) conduit parfois à la découverte d'un cancer jusque là méconnu. Nous nous proposons de passer en revue les nombreuses questions que posent en pratique cette hypothèse. Nous illustrerons ces réponses à partir d’une enquête épidémiologique menée dans le département de l’Isère et des nombreux travaux maintenant disponibles sur ce thème.
Présentation de l’étude épidémiologique en Isère
Le principe de cette étude est la confrontation de deux registres informatiques. Le registre de la MTE du CHU de Grenoble enregistre systématiquement tous les cas de MTE diagnostiqués au sein de cet établissement quelque soit le service d’origine des patients (Urgences, Médecine, Chirurgie ...). Le registre du cancer de l’Isère enregistre lui tous les cas de cancer diagnostiqués dans l’Isère. Nous avons ainsi sélectionné 1250 patients domiciliés dans l'Isère ayant présenté un épisode de MTE prouvé entre 1983 et 1986 (54 % femmes, âge moyen 65 ans, de 2 à 100 ans). Le registre du cancer nous a fourni pour ces patients l'information sur l’existence ou non d’un cancer et le délai entre l’épisode de MTE et le diagnostic de cancer.
Existe-t-il une relation de cause à effet entre cancer et MTE ?
La réponse est oui sans ambiguïté avec des arguments multiples.
Le cancer est un facteur de risque majeur de MTE avec un risque relatif de l’ordre de 2 à 3. Les études autopsiques montrent également la présence plus fréquente de thrombii chez les patients cancéreux. Compte tenu de la nécessité d’une prévention dont la durée peut dépasser plusieurs semaines l’intérêt, bien établi, des AVK à faible doses pour la prévention de la MTE est à souligner (1).
Il existe de nombreux cas cliniques rapportant des épisodes de MTE, le plus souvent récidivante (parfois sous anticoagulants), multifocale, conduisant à la découverte d’un cancer. Ces cas cliniques s’inscrivent directement dans la lignée de la description initiale de Trousseau en 1865 (2). L’ancienneté de cette description, le nombre de publications depuis cette première description sont autant d’arguments indirectes en faveur de la réalité de cette relation. Dans une étude portant sur 1694 patients cancéreux, la MTE apparait comme le syndrome paranéoplasique le plus fréquent après les manifestations rhumatologiques. Il ne s’agit toutefois que de 33 patients (1,9%) (3).
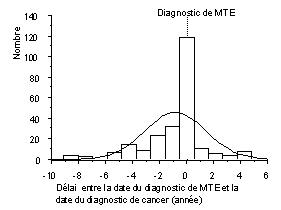
Dans notre étude, sur 1250 patients ayant présenté un épisode de MTE certain, 249 ont eu ou auront un cancer (20 %). Ce premier chiffre par son ampleur même confirme l’importance clinique de cette relation. Si l’on étudie le délai entre le diagnostic de MTE et le diagnostic de cancer, on constate qu’il s’agit surtout de MTE venant compliquer un cancer connu (171 cas (13,7 %)); 19 cancers ont été découverts dès l’admission à l’hôpital et 59 cancers ont été découverts dans les suites. L’analyse de la distribution du délai entre le diagnostic de MTE et le diagnostic de cancer montre clairement la concomitance temporelle de ces deux pathologies (fig. N°1). Cette distribution est symétrique centrée à - 3 mois avant l’épisode de MTE. Elle s’écarte d’une distribution normale par la sur représentation des cas autour de cette période. Pour la moitié des cas, le cancer a été diagnostiqué dans l’année précédant l’épisode de MTE ou dans l’année suivant l’épisode de MTE. Ce regroupement est remarquable puisque la période de suivi va de 10 ans avant la MTE à 6 ans après. Ces arguments de concordance temporelle ne représentent toutefois pas une démonstration de relation causale.
Mécanismes de la relation MTE cancer
Il existe chez les patients cancéreux une hypercoagulabilité en rapport avec la production par les cellules cancéreuses de substances entrant en interaction avec les plaquettes, le système de la coagulation et de la fibrinolyse. ces facteurs ont également des actions procoagulantes directes sur les cellules endothéliales (4). L’ensemble de ces anomalies peuvent expliquer qu’une tumeur de petite taille (indécelable cliniquement et difficilement accessible aux examens paracliniques) entraîne à distance des thromboses.
On trouve chez les patients cancéreux les autres éléments de la triade de Virchow : la stase, par compression extrinsèque ou décubitus, et les atteintes pariétales par envahissement. Lorsqu’une thrombose survient du fait de ce type de mécanisme, le cancer en cause est toujours à un stade développé et son diagnostic, s’il était méconnu jusque-là, ne pose pas de problème en pratique.
Quelle est l’incidence de cancer découvert après un épisode de MTE ?
Sur 1059 patients avec MTE et idem de cancer, nous avons découvert 59 cas de cancer dans les suites de la MTE (5,6 %) dont 25 cas dans les 6 mois suivant l’épisode de MTE. Plusieurs études publient des chiffres compris entre 6 et 15% (Tableau 1). Il s’agit toujours de séries hospitalières avec un recrutement plus ou moins spécialisé (5, 6, 7, 8, 9). L’étude de Nordström menée à partir d’un service de radiologie est probablement la plus représentative d’un recrutement hospitalier (9). Il retrouve 11 % de cancers dont 66 cas de cancer sur 1383 patients (4,7%) dans les six mois après la TVP. Une étude prospective menée en milieu libéral par des angiologues n’a, par contre, retrouvé que 2 % de cancers sur 128 patients (10).
Un diagnostic de cancer sera donc porté dans les deux ans chez 5 à 10 % des patients ayant présenté un épisode de MTE chez des patients pris en charge en milieu hospitalier.
L'incidence de cancer est-elle supérieure en cas de MTE ?
Les études comparant des patients avec MTE authentifiée à des patients suspects de MTE mais pour lesquelles les explorations sont négatives ne sont pas toutes concordantes (Tableau 1). Griffin ne trouve pas de différence significative. Le risque de cancer est multiplié par 2 par rapport à la population générale mais pour les cas comme pour les témoins de son étude (6). A l’inverse, d’autres études montrent un risque supplémentaire. L’étude de Nordström est la plus convainquante, par le nombre de patients concernés et par la méthodologie employée. Il retrouve 150 cancers sur 1383 cas (phlébographie positive) contre 182 cancers chez 2412 témoins ( phlébographie négative). En fait cette surincidence minime (11 % vs 7,5 %) n’est significative que dans les 6 premiers mois : 66 cancers pour les cas (4,7 %) vs 37 cancers pour les témoins (1,5 %). Après 6 mois l’incidence de cancer n’est pas statistiquement différente entre les deux groupes (9).
Une surincidence de cancer dans les suites est donc probable mais le risque relatif ne semble pas très élevé entre des patients avec MTE et des patients comparables avec suspicion de MTE négative.
Existe-t-il des formes cliniques de MTE à plus fort risque de cancer ?
Tous les patients avec MTE ne présentent pas le même risque de découverte d’un cancer occulte. Les deux éléments les plus importants pour la définition de sous groupes de patients à haut risque de cancer occulte sont la notion de MTE récidivante et de MTE inexpliquée.
La notion de MTE idiopathique est la mieux étudiée (tableau 2). Dans notre étude, l’incidence de cancer est de 1,9 % dans le groupe de patients avec MTE post opératoire versus 6,1 % en l’absence de facteur déclenchant chirurgical (risque relatif : 3,1 IC à 95% 1,2 ; à 7,4 %; p = 0,04). Prandoni retrouve 2 cancers chez 105 patients avec MTE secondaire vs 16 cancers chez 153 patients avec MTE inexpliquée (bilan initial plus suivi). Dans son étude, la probabilité de découverte d’un cancer après le bilan initial négatif est multipliée par 2,3 à 95% 1 à 5,2 %; p = 0,05) en présence d’une TVP idiopathique (11). Pour Bastounis le risque serait encore plus élevé avec un risque relatif de l’ordre de 5 (12).
La notion de MTE récidivante est le deuxième élément permettant la définition d’un sous groupe à plus forte probabilité de découverte d’un cancer. Dans notre étude, le risque relatif de diagnostic de cancer dans les suites est de 2,6 (IC à 95% 1,2 à 5,8 %; p =0,03) pour les patients avec récidives de MTE (12 % de cancer ultérieur) par rapport aux patients sans récidive (4,5 % de cancer). Dans l’étude de Prandoni le risque de cancer est multiplié par 2 en cas de récidive de MTE (11).
Les autres caractéristiques de la MTE ne semblent pas apporter d’autres éléments (thrombose multifocale, thrombose suspendue, mobilité du thrombus, localisation du thrombus).
Existe-t-il des cancers plus fréquemment associés à la MTE ?
La plupart des cancers sont incriminés dans la relation MTE et cancer. Dans notre étude, les cancers les plus fréquemment retrouvés dans les suites d’une MTE sont les cancers digestifs (25 %), les cancers du poumon (11 %), les cancers de prostate (11 %) et les cancers du sein (11%). Cette répartition est en fait très proche de la répartition observée au niveau de l’ensemble des patients du registre du cancer de l’Isère pour des tranches d’âges équivalentes. La plupart des études épidémiologiques montrent la grande diversité des cancers rencontrés dans les suites d’une MTE. Les études autopsiques montrent une plus grande fréquence de MTE en cas de cancer du pancréas, de l’estomac ou de l’ovaire. En pratique seuls les cancers malphigiens de la sphère ORL ne semblent pas être liés à la MTE.
En pratique : Quel bilan ? Pour quel patient ?
Pour être justifiée, une politique de dépistage de cancer doit : améliorer le pronostic vital ou la qualité de vie, ne pas faire courir de risque aux patients, cibler une population à haut risque et être raisonnable en terme de coût de santé compte tenu de la prévalence très importante de la MTE.
Pour les patients présentant un épisode de MTE expliqué par la concordance entre une situation à risque (post-op ...) chez un patient à risque (obésité...) un examen clinique attentif parait suffisant et néanmoins nécessaire. En effet la MTE survient chez des patients présentant, indépendamment d’une éventuelle relation causale entre cancer occulte et MTE, un risque de cancer plus élevé que la population générale. De ce fait, il est indispensable de pratiquer pour tous les patients avec MTE un examen clinique et un interrogatoire très soigneux à la recherche de signes d’appel pouvant justifier la réalisation d’examens complémentaires orientés.
Pour les patients présentant un épisode de MTE mal expliqué (présence d’un facteur de risque mineur et absence de facteur déclenchant par exemple) un examen clinique complet incluant les gestes de dépistage des cancers accessibles à la clinique (prostate, utérus, sein, peau), un bilan biologique d’orientation, un examen attentif de la radiographie du thorax, voir une échographie abdomino-pelvienne semblent justifié le plus souvent. Un simple suivi clinique à 6 mois est suffisant.
Pour les patients, présentant une MTE totalement inexpliquée (ni facteur de risque ni facteur déclenchant) ou une MTE récidivante, ces mêmes investigations s’imposent impérativement. Elles pourront être réitérées dans les 3 à 6 mois en l’absence d’étiologie autre que néoplasique (bilan d’hémostase et bilan immunologique négatif).
Les marqueurs néoplasiques biologiques n’ont aucune place dans une stratégie de dépistage du cancer. Seule peut se discuter la place des marqueurs du cancer de la prostate en complément de l’examen clinique. Les endoscopies digestives haute ou basse, l'endoscopie bronchique n’ont pas d’indication en dehors de signes d’appel cliniques sauf cas très particuliers.
Conclusion
La relation entre une MTE et un éventuel cancer totalement
asymptomatique est une réalité. Il s’agit néanmoins d’une
éventualité rare ne justifiant pas d’inquiéter inutilement
tous les patients présentant un épisode de MTE. Des investigations
complémentaires systématiques simples doivent être proposées
aux patients avec MTE inexpliquée (mal expliquée ?) et/ou récidivante.

Figure N°1 : Distribution du délai entre le diagnostic de MTE et le
diagnostic de cancer (n = 249 patients).
| Auteurs | Etudes | Cas | Témoin | Suivi | cancer connu | cancer découvert (RR) |
| GORE | rétrospective | EP (angio +) n = 128 | Angio - n = 128 | 2 ans | 12 % | 15 % (4,7) |
| GRIFFIN | rétrospective | TVP et/ou EP | Suspicion MTE - | > 2 ans | 12 % | 8 % (1) |
| GOLDBERG | rétrospective | Toutes TVP (RPO +) n = 370 | RPO - n = 1073 | > 2 ans | 6,3 % (2,7) | |
| BARRELIER | prospective bilan systèmatique J0 | TVP ambulatoires n = 128 | Pas de témoin | Pas de suivi | 2 % | |
| MONREAL | Prospective | Toutes TVP n =113 | Pas de témoin | 1 an | 30 % | 10 % |
| Nordström | Prospective | Phlébo + n =1383 | Phlébo - n = 2412 | > 2 ans | 11 % (1,5) |
Tableau 1:
Incidence
de cancer après maladie thrombo-embolique
| Auteurs | Etudes | Cas | Témoin | Suivi | cancer découvert |
| PRANDONI | Prospective 250 patients | TVP idiopathiques (I) | TVP secondaires (S) | 24 mois | 6,9 % I : 16/153 (10 %) S : 2/107 (1,5 %) |
| Bastounis | Prospective 286 patients | TVP idiopathiques (I) | TVP secondaires (S) | 24 mois | 10 % I : 21/84 (25%) S : 8/202 (4%) |
Tableau 2 : Incidence de cancer après maladie thrombo-embolique en fonction du caractère idiopathique ou secondaire de la MTE.
Bibliographie
* 1 Levine M; Hirsh J; Gent M; Arnold A; et al. Double-blind randomised trial of a very-low-dose warfarin for prevention of thromboembolism in stage IV breast cancer. Lancet, 343: 8902, 1994 Apr 9, 886-9.
2 Trousseau A. Phlegmatia alba dolens. Clinique Médicale de l'Hôtel Dieu. Paris Baillière Ed, Paris 1865 : 654-712.
3 Zuffa M; Kubancok J; Rusnák I; Mensatoris K; Horváth A. Early paraneoplastic syndrome in medical oncology: clinicopathological analysis of 1694 patients treated over 20 years. Neoplasma, 31: 2, 1984, 231-6.
4 Donati MB. Cancer and thrombosis. Haemostasis, 24: 2, 1994 Mar-Apr, 128-31.
5 Gore JM; Appelbaum JS; Greene HL; Dexter L; Dalen JE Occult cancer in patients with acute pulmonary embolism. Ann Intern Med, 96: 5, 1982 May, 556-60.
6 Griffin RM, Stanson AW, Brown ML. Deep venous thrombosis and pulmonary embolism: risk of subsequent malignant neoplasm. Arch Intern Med 1987 ; 147 : 1907-11.
7 Goldberg JR, Seeff M, Gore MJ. Occult malignant neoplasm in patients with deep venous thrombosis. Arch Intern Med 1987 ; 146 : 962-7.
8 Monreal M, Lafoz E, Casals A. Occult cancer in patients with deep venous thrombosis: a systematic approach. Cancer 1991 ; 67 (2).
** 9 Nordström M; Lindblad B; Anderson H; Bergqvist D; Kjellström T. Deep v enous thrombosis and occult malignancy: an epidemiological study. BMJ, 308: 6933, 1994 Apr 2, 891-4.
10 Barrellier MT; Carpentier P; Henriet JP; Lequerrec A; Derlon J; Khayat MC; Agron L; Letellier P. Etude étiologique prospective de 128 patients avec une thrombose veineuse profonde survenue en ambulatoire. J Mal Vasc, 17: 4, 1992, 277-83.
** 11 Prandoni P; Lensing AW; Büller HR; Cogo A; Prins MH; Cattelan AM; Cuppini S; Noventa F; ten Cate JW. Deep-vein thrombosis and the incidence of subsequent symptomatic cancer. N Engl J Med, 327: 16, 1992 Oct 15, 1128-33. Lensing AW; Büller HR; Cogo A; Prins MH; Cattelan AM; Cuppini S; Noventa F; ten Cate JW. Deep-vein thrombosis and the incidence of subsequent symptomatic cancer. N Engl J Med, 327: 16, 1992 Oct 15, 1128-33. Büller HR; Cogo A; Prins MH; Cattelan AM; Cuppini S; Noventa F; ten Cate JW. Deep-vein thrombosis and the incidence of subsequent symptomatic cancer. N Engl J Med, 327: 16, 1992 Oct 15, 1128-33.
12 Bastounis EA; Karayiannakis AJ; Makri GG; Alexiou D; Papalambros EL. The incidence of occult cancer in patients with deep venous thrombosis: a prospective study. J Intern Med, 239: 2, 1996 Feb, 153-6.
Article reproduit dans SMEL grâce à l'aimable autorisation des auteurs.