


L'embolie pulmonaire (EP) se définit comme l'oblitération brusque du tronc ou d'une branche de l'artère pulmonaire le plus souvent par un caillot fibrino-cruorique venant d'une thrombose veineuse profonde des membres inférieurs (TVP) : concept de maladie thrombo-embolique (MTE).
|
|
|
| . |
|
|
C'est une pathologie fréquente et potentiellement grave :
USA : 5 M de TVP, 650 000 MTE, 200 000
décès associés, 50 000 décès
liés directement à l'EP, 0,1 à 0,2 % évoluent
vers la thrombose chronique.
France : 13 000 à 56 000 nouveaux cas annuels en France
: 3 ème maladie cardiovasculaire après AVC et insuffisance
coronaire.
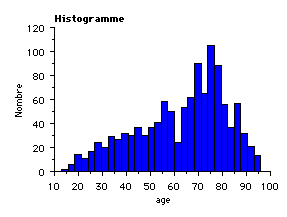
Il s'agit essentiellement d'une pathologie d'accompagnement caractéristique du sujet âgé comme le montre l'histogramme de l'âge des patients suspects d'EP dans notre CHU (médiane de l'âge = 68 ans, extrêmes de 13 à 96 ans).
Le diagnostic est difficile car il n'existe pas d'examen simple, accessible à tous, sensible et spécifique.
Tous les cliniciens doivent savoir évoquer ce diagnostic, utiliser la filière diagnostique et initier un traitement.
On distingue comme pour la TVP des facteurs de risque propres au patient (Age, ATCD de MTE...) et des facteurs déclenchants (chirurgie...). Ces éléments sont résumés dans le tableau 1.
L'âge est un facteur de risque majeur plus du fait des comorbidité favorisant la survenue d'une EP que par son rôle propre. En pratique la moyenne d'âge des patients avec EP est de 69,5 ans (DS = 17 ans) alors que la moyenne d'âge des patients sans EP (suspicion négative) est de 63 ans (DS = 17 ans, p < 0,01).
Plus rarement, moins de 5 % des cas, il existe un déficit congénital de la coagulation. Le déficit en anti thrombine III est exceptionnel mais très thrombogène; les déficits en protéine C et S sont rares avec un risque de thrombose moindre alors que la résistance à la protéine C activée (RPCA) serait retrouvé dans 10 à 20 % des cas de MTE mais avec un risque thrombogène encore plus modeste. C'est une mutation d'un codon sur le gène codant pour le facteur V empêchant la protéine C activée de cliver le facteur Va.
Les états d'hypercoagulabilité peuvent également être acquis (anticorps antiphospholipides et lupus, déficit en ATIII et syndrome néphrotique par exemple).
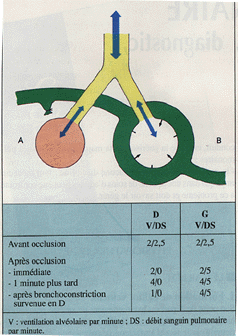
- conséquences pulmonaires
* effet espace mort : zone ventilée non perfusée, mesurée en clinique par le gradient alvéolo-artériel en CO2.
* hypoxémie : 3 mécanismes : effet shunt lié à des rapports V/Q bas dans les zones non embolisées, et dans les EP graves hypoxémie par bas débit et réouverture du foramen ovale.
* hypocapnie par hyperventilation réponse à l'hypoxémie, responsable parfois de bronchospasme.
* infarctus pulmonaire par ischémie distale plus fréquent chez l'insuffisant cardiaque.
- conséquences cardiaques :
* augmentation des résistances pulmonaires
* Pression Artérielle Pulmonaire systolique (PAPs) peut atteindre en aiguë 35-40 mmHg, au delà s'installe une Insuffisance Ventriculaire Droite et un choc avec intolérance hémodynamique définissant l'EP grave. Si PAPs > 40 mmHg : histoire chronique ou récurrente probable.
Le clinicien doit savoir reconnaître trois tableaux l'EP aiguë le plus fréquent, l'EP grave et la thrombose chronique des artères pulmonaires (tableau 2).
3.1 La Clinique
Signes cliniques de l'EP aiguë
Dyspnée, douleur thoracique de type pleurale, hyperthermie entre 37,5° C et 38,5° C tachycardie, et tachypnée supérieure à 20 sont les signes les plus fréquents mais peu spécifiques (tableau 3)
Les manifestations trompeuses de l'embolie pulmonaire sont nombreuses : arythmie, fièvre, confusion mentale, défaillance cardiaque résistante, bronchospasme grave...
Dans notre expérience, la dyspnée est le signe clinique le plus fréquent (sur 1168 patients suspects d'EP 805 (69%) présentaient une dyspnée). C'est également le signe la plus évocateur puisque 192 patients sur ces 805 (24%) avaient réellement une EP contre 45 EP pour les 363 patients sans dyspnée (12,5 % ; test du Chi-Deux : p < 0,001). La présence de signes cliniques de TVP beaucoup moins fréquents (20% des cas), semble également bien lié à l'EP puisque l'on observe 30 % d'EP en présence de signes de TVP (76/250) contre seulement 17,5 % (161/918; p<0,01) en l'absence de signe de TVP.
La clinique est indispensable pour évoquer
le diagnostic. Les signes cliniques peu spécifiques prennent
plus de valeur en fonction du contexte (présence de facteur
de risque et/ou de facteur déclenchant de MTE). L'association
de la clinique et de ces notions de facteurs de risque doit permettre
l'
estimation
d'une
probabilité
clinique d'EP. Cette
probabilité
clinique a priori
est nécessaire pour gérer l'enchaînement et
l'interprétation des examens complémentaires qui
seront toujours indispensables pour affirmer ou éliminer
le diagnostic d'EP. En pratique,
en utilisant une
estimation
empirique de la probabilité
d'EP nous avons observé une
prévalence
de l'EP qui
croit régulièrement avec le niveau de probabilité
clinique
(test du chi-deux
p<0,01 et
test de tendance linéaire
p< 0,01).
| Probabilité clinique d'EP |
|
|
|
|
| Prévalence réelle d'EP |
|
|
|
|
3.2 Les examens complémentaires de base
Radio pulmonaire : rarement normale : 20% ECG
: utile pour le diagnostic différentiel et pour quelques
signes les plus fréquents
dans l'EP
Gaz du sang:
indispensables pour apprécier la gravité, hypoxémie
et hypocapnie sont non spécifiques. Ils peuvent apporter
des éléments
en faveur d'une EP
D-Dimère plasmatique 3.3 Les
examens complémentaires de confirmation
Scintigraphie pulmonaire
Ventilation /Perfusion En présence d'une pathologie pulmonaire
associée les
valeurs prédictives
positives ou négatives
sont inchangées mais la scintigraphie sera beaucoup plus
souvent de
probabilité
intermédiaire donc non décisionnelle.
Echo-doppler veineux - Thrombose chronique Angiographie pulmonaire : méthode diagnostic de référence
mais.. 3.4 Diagnostic différentiel
Pièges pouvant simuler une embolie
pulmonaire mineure : Bronchite aiguë,
Crise d'asthme, Pneumonie,
Douleur musculo-squelettique de la paroi
thoracique, Péricardite,
Spasme oesophagien, Anxiété.
Pièges diagnostiques pouvant simuler
une embolie pulmonaire majeure : Infarctus du myocarde,
Infection aiguë chez un BPCO,
Choc septique, Hémorragie
sévère occulte, Anévrysme
disséquant de l'aorte.
3.5 Propositions
de stratégie diagnostique
La multiplicité des examens complémentaires
reflète à l'évidence le fait qu'aucun d'entre
eux n(est parfait.Il n'existe pas de stratégie diagnostique
univoque. Cette proposition fait référence à l'ensemble
des possibilités du plateau technique et prend en compte
la notion de
probabilité
clinique. D'autres stratégies
sont possibles. Dans tous les cas il faut connaître les
limites de chacun des examens et savoir les intégrer dans
une démarche clinique.
3.6 Situations particulières
L'embolie pulmonaire grave
est définie par l'intolérance hémodynamique
imposant des mesures immédiates compte tenu du risque vital
majeur à court terme. Devenue plus rare grâce au
progrès de la prévention et du diagnostic c'est
une urgence absolue.
LA THROMBOSE CHRONIQUE ARTÉRIELLE
PULMONAIRE
La thrombose chronique
artérielle pulmonaire est une
forme d'évolution peu fréquente mais de mauvais
pronostic.
LES EMBOLIES PULMONAIRES NON CRUORIQUES
De manière exceptionnelle les
embols peuvent ne pas être d'origine fibrino-cruorique (embols néoplasiques et cancer du rein
par exemple).
Maladie grave à court terme et
à 1 an. Le risque de récidive de MTE est compris
entre 5 et 10 % à un an sous traitement bien conduit. Exemples
:
- 5 décès et 5 récidives
/ 19 sujets non traités versus 0 décès et
0 récidives chez 16 sujets traités (première
et seule étude comparant l'héparine à un
placebo)
- 399 EP dont 375 traitées et
suivies sur 1 an :
+ 10 décès (2,5 %) par
EP,
+ 33 récidivent (8,3 %), la moitié
dans la première semaine ; 45 % décèdent
Le risque de décès à
un an est élevé (de l'ordre de 10 à 25 %).
Le plus souvent c'est la pathologie associée qui est responsable
du décès. La MTE est alors un marqueur du risque
de décès témoin de la gravité de la
pathologie sous jacente. Exemple : L'évolution vers un coeur pulmonaire
chronique est de l'ordre de 1 % des cas
Il ne se conçoit qu'en milieu
hospitalier.
Oxygénothérapie adaptée
en fonction des gazs du sang et prise en charge de la douleur
sont nécessaires.
Le traitement de base repose sur les
anticoagulants dont l'objectif principal est la prévention
des récidives.
En première intention c'est l'héparinothérapie.
Elle doit être débutée immédiatement
en cas de forte suspicion clinique et poursuivie ou non en fonction
des résultats des examens complémentaires.
L'héparine non fractionnée
doit être initialisée par un bolus intraveineux d'héparine
(100 UI/kg/j) suivi par un traitement intraveineux continu au
pousse-seringue avec une posologie adaptée au poids du
patient (500 UI/Kg/J) puis en fonction du Temps de Céphaline
Activée (TCA entre 1,5 et 2 fois le témoin).
Les HBPM, d'action anticoagulante immédiate
et stable, ont fait la preuve de leur efficacité en une
injection par jour (Innohep) ou deux (Clivarine) mais n'ont pas
encore à ce jour l'AMM dans le traitement de l'EP. Comme
pour la TVP leur simplicité d'utilisation sera leur principale
avantage.
Les anticoagulants oraux (Antivitamines
K) peuvent être envisagés en l'absence de contre-indication
dès les premiers jours de traitement en relais de l'héparinothérapie
en l'absence de geste invasif prévisible. Après
introduction de l'AVK on doit poursuivre l'héparinothérapie
jusqu'à l'obtention d'un INR entre 2 et 3. En pratique
3 à 6 jours sont nécessaires. Il est recommandé
d'utiliser des AVK de demi-vie longue (Préviscan, Apegmone,
Coumadine) plus stable à long terme.
Le décubitus strict reste la règle
mais ne doit pas dépasser 2 à 3 jours sauf très
rares exceptions liées à la nature de la TVP.
La durée du traitement anticoagulant
varie de 3 à 6 mois ou
plus en fonction du contexte et de l'évolution de la perfusion
pulmonaire et du foyer emboligène. Les EP non grave sans
foyer emboligène survenue dans un contexte transitoire
(exemple post opératoire) peuvent peut-être bénéficiées
de traitement de 6 semaines. En dehors de ce cas précis
des traitements trop court expose à un risque important
de récidives de MTE. Après une période de
3 à 6 mois de traitement c'est le retour à une fonction
pulmonaire et veineuse normale qui en l'absence d'antécédents
particuliers autorise l'arrêt des anticoagulants. En cas
d'EP récidivante et/ou de facteur de risque de MTE persistant
le traitement anticoagulant doit être poursuivi 1 an voir
"à vie" si plus de 2 récidives.
- L'interruption partielle de
la veine cave inférieure permet par
la mise en place d'un barrage mécanique sur la veine cave
une prévention des migrations emboliques par filtre endocave
percutané. Les indications principales sont les échecs
du traitement anticoagulant (récidive embolique certaine
sous traitement bien conduit, contre-indication formelle aux anticoagulants).
Pour les EP graves en complément
de l'héparinothérapie ont discutera une fibrinolyse
(Actylise, urokinase, streptokinase) par voie générale
ou une thrombectomie chirurgicale. Dans tous les cas une évaluation
précise des avantages et risques de ces deux traitements
sera indispensable.
L'EP reste une pathologie fréquente
et grave. Le diagnostic de la MTE est devenue plus aisé
et moins invasif. Il repose dans tous les cas sur une évaluation
précise de la clinique. Néanmoins il ne faut pas
décider d'un traitement toujours risqué sur le seul
"sens clinique".
Intérêts pour évoquer un diagnostic différentiel
et également pour les signes
dont la fréquence est accrue au cours de l'EP
Produits de dégradation de la fibrine, ils sont pratiquement
toujours positifs en cas de MTE
(sensibilité
> 95%)
avec un
seuil
de 500 µg/l en ELISA mais non spécifique.
Ils n'ont donc de valeur que négatifs pour éliminer
une MTE. Il faut limiter les indications aux patients sans
cancer évolutif, ni pathologie inflammatoire chronique,
ni chirugie récente et agés de moins de 80 ans (toutes
circonstances qui entrainent un taux positif de d-dimères
indépendamment de la présence d'une MTE). Dans ces
conditions on observe un taux de d-dimères négatifs
de 50 % (280 sur 552 dosages en l'absence des 3 circonstances)
contre seulement 8 % de négatifs (4/46) en présence
de l'une de ces circonstances (p < 0 ,001). En cas de très
forte probabilité
clinique d'EP il faut demander directement
d'autres examens complémentaires afin de limiter le risque
de faux négatif.
C'est un examen sensible délivrant une faible irradiation
sans risque d'allergie mais peu spécifique
- une scintigraphie avec une perfusion normale élimine
une EP
- une haute probabilité
a une
valeur prédictive
d'EP de 97%
- une
probabilité
intermédiaire est non décisionnelle
: 10 à 70 % d'EP (67% des patients !). Il faut alors demander
d'autres examens (voir stratégie diagnostique)
Permet de retrouver une TVP dans 70% des EP. Devant une forte
suspicion clinique d'EP la découverte d'une TVP proximale
permet de retenir le diagnostic d'EP et dans tous les cas a les
mêmes conséquences thérapeutiques (anticoagulant
3 à 6 mois). ). La mise en évidence d'une
TVP surale ne suffit pas à affirmer le diagnostique d'EP
(seulement 60 % d'EP dans ce cas). Il est donc impératif
de poursuivre les investigations. L'absence de TVP en écho-doppler
n'élimine en aucun cas le diagnostic d'EP.
La recherche du foyer emboligène est indispensable pour
une prise en charge spécifique de la TVP.
Echographie cardiaque : intérêts si EP grave
ou thrombose chronique.
Elle résume le diagnostic si EP grave avec choc.
Elle apporte des renseignements pronostiques dans la thrombose
chronique et des éléments en faveur d'un diagnostic
différentiel dans les formes graves avec intolérance
hémodynamique(choc cardiogénique, dissection aortique,
choc septique...)
TDM hélicoïdale avec injection
Examen spécifique mais pas encore parfaitement sensible.
Il nécessite une irradiation non négligeable et
une injection iodée.
Il paraît particulièrement indiqué dans 3
situations :
- EP grave
très sensible et spécifique, mise en oeuvre rapide,
moins dangereux qu'une angiographie pulmonaire.
- EP aiguë avec Scintigraphie non diagnostique et EFV négatives
ou EP aiguë avec pathologie pulmonaire associée rendant
peu décisionnel la scintigraphie
Contribue au diagnostic et précise les indications : thromboendartériectomie
?
l'interprétation est difficile (8%-17% discordance). Problème
d'accessibilité, de faisabilité et de coût.
C'est actuellement un examen de deuxième intention.
4 Evolution
- Mortalité à 6 ans chez 300 patients :
- 15% chez patients chirurgicaux et traumatiques
- 25% chez patients avec MTE "primitive" (10% avec Kc)
- 50% chez patients avec cardiopathie
5 Traitement
6 Conclusion

